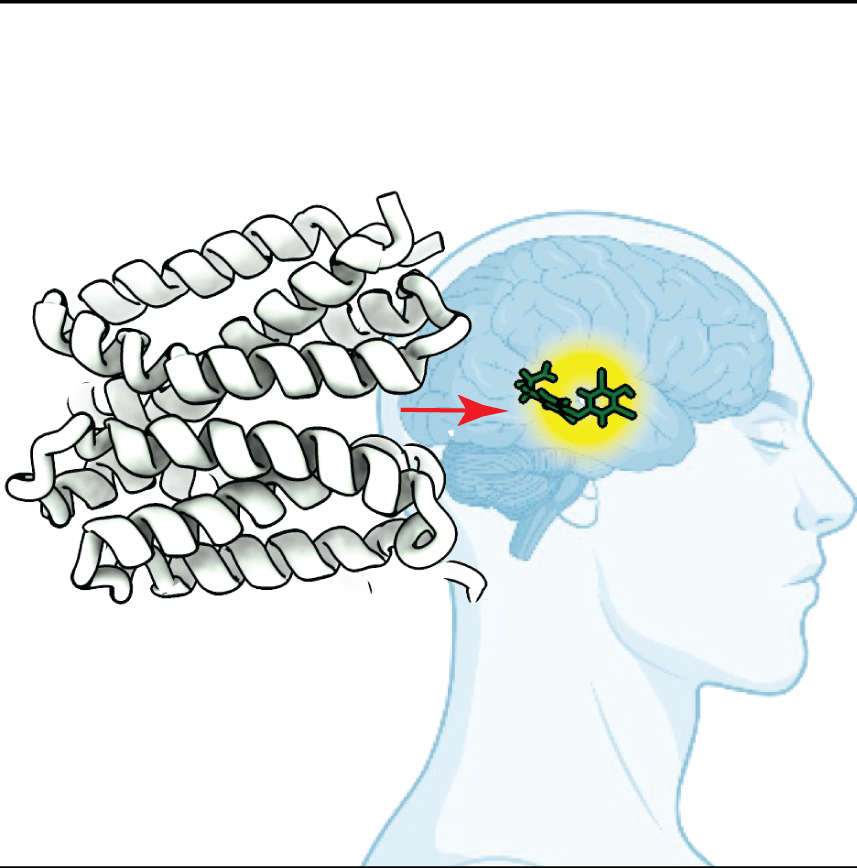
Come gli ormoni tiroidei vengono trasportati nelle cellule bersaglio
Una collaborazione internazionale tra i ricercatori di Human Technopole e dell’Erasmus Medical Centre ha fatto luce sui meccanismi molecolari che regolano il trasporto degli ormoni tiroidei nelle cellule umane tramite i trasportatori di monocarbossilati (MCT). I risultati della ricerca sono stati pubblicati su Nature Communications.
Gli ormoni tiroidei, inclusi la tiroxina (T4) e la triiodotironina (T3), sono essenziali per lo sviluppo cellulare e la regolazione del metabolismo. Vengono sintetizzati nella ghiandola tiroidea, rilasciati nel flusso sanguigno e trasportati attraverso le membrane cellulari dai MCT8 e MCT10, membri della famiglia dei MCT. Le mutazioni nel gene SLC16A2, che codifica per MCT8, causano gravi disturbi neuroevolutivi e metabolici dovuti a un trasporto compromesso degli ormoni tiroidei (Sindrome di Allan-Herndon-Dudley). Comprendere i meccanismi di trasporto di MCT8 e MCT10 è dunque cruciale per identificare bersagli terapeutici per le condizioni legate a MCT8.
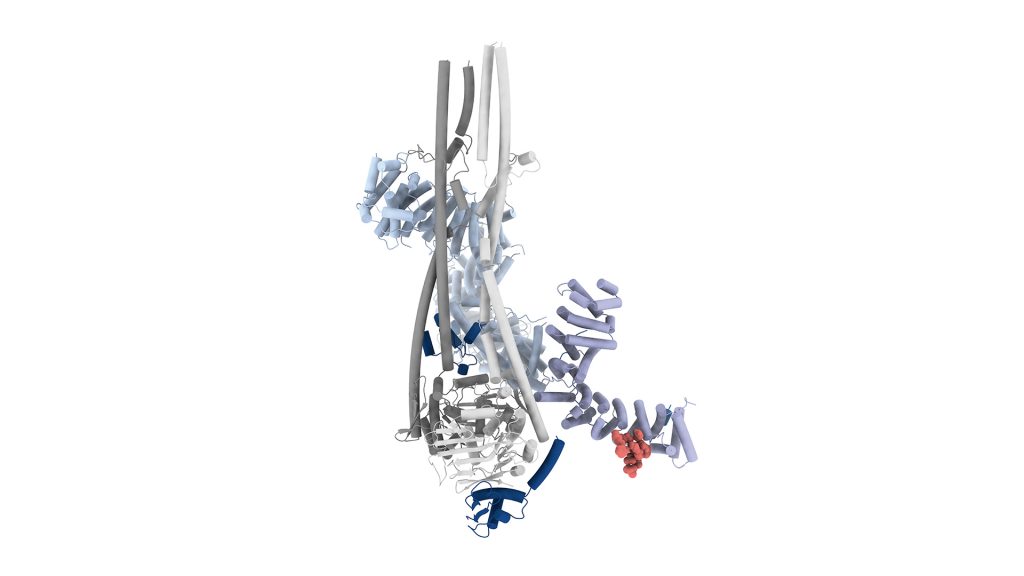
Il gruppo di Francesca Coscia (Human Technopole, Italia) in collaborazione con quello di Edward Visser (Erasmus Medical Centre, Paesi Bassi) hanno utilizzato la microscopia crioelettronica (cryo-EM) per determinare cinque stati strutturali di MCT8 e MCT10, catturando le conformazioni prive di ligando, legate alla tiroxina e legate agli inibitori, oltre a un mutante MCT8 derivato da pazienti (D424N). I dati strutturali sono stati supportati da una serie di saggi biofisici di legame e test di captazione cellulare del T4. Le immagini strutturali ottenute hanno offerto una panoramica del ciclo di trasporto del T4 e della base molecolare dell’inibizione di MCT8 da parte della silicristina. Queste analisi hanno rivelato che il legame del T4 induce una serie di cambiamenti conformazionali in MCT8 e MCT10, coinvolgendo una rete di residui conservati, tra cui R371, Y339 e N119. Questi residui sono posizionati strategicamente per facilitare le transizioni conformazionali dallo stato rivolto verso l’esterno (OFS) allo stato rivolto verso l’interno (IFS), permettendo il rilascio del T4 sul lato opposto della membrana.
I dati strutturali mostrano che le strutture di MCT8 prive di ligando e legate al T4 sono quasi identiche, salvo leggere variazioni nell’elica transmembrana 7 (TMH7), che occludono parzialmente il gate. Questo cambiamento conformazionale localizzato innesca una serie di aggiustamenti molecolari che facilitano il rilascio del T4 nello stato IFS.
I ricercatori hanno anche esaminato il mutante patogeno MCT8 D424N, associato a gravi deficit neuroevolutivi nei pazienti. La mutazione D424N introduce un cambiamento conformazionale sottile ma significativo che compromette la stabilità del gate centrale, impedendo il trasporto del T4 pur mantenendo la capacità di legarlo. L’analisi strutturale del mutante D424N ha rivelato che questa mutazione aumenta la flessibilità di TMH7 e TMH10, portando a una chiusura del gate meno efficiente e a un’attività di trasporto compromessa. Questo risultato suggerisce che il residuo D424 svolge un ruolo cruciale nel mantenere l’integrità strutturale del trasportatore durante la transizione dallo stato OFS a IFS.
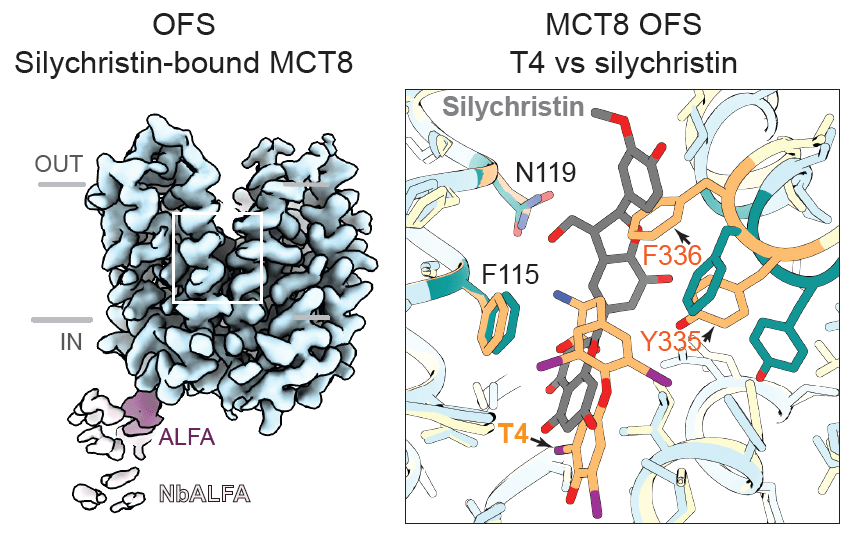
Infine, i gruppi di ricerca hanno analizzato il meccanismo inibitorio della silicristina, un composto vegetale noto per inibire selettivamente MCT8. L’analisi cryo-EM di MCT8 legato alla silicristina ha rivelato che l’inibitore occupa la stessa tasca di legame del T4, ma con interazioni distinte che impediscono i cambiamenti conformazionali necessari per il trasporto del T4. La silicristina stabilizza MCT8 nello stato rivolto verso l’esterno, bloccando efficacemente il trasportatore in una conformazione non produttiva.
Questo studio ha implicazioni significative per la comprensione della base molecolare del trasporto degli ormoni tiroidei e della sua alterazione nelle patologie. Chiarendo le dinamiche strutturali del legame, del trasporto e dell’inibizione del T4, i ricercatori forniscono un quadro completo per identificare potenziali bersagli terapeutici nei disturbi legati a MCT8. L’individuazione di residui critici coinvolti nel trasporto del T4, come D424, R371 e F336, suggerisce potenziali siti per lo sviluppo di farmaci volti a stabilizzare o modulare la conformazione del trasportatore. Inoltre, i profili di legame differenziati del T4 e della silicristina evidenziano la possibilità di progettare inibitori selettivi in grado di modulare l’attività di MCT8 senza influenzare MCT10, offrendo una strategia terapeutica per il trattamento di condizioni legate alla disfunzione di MCT8.
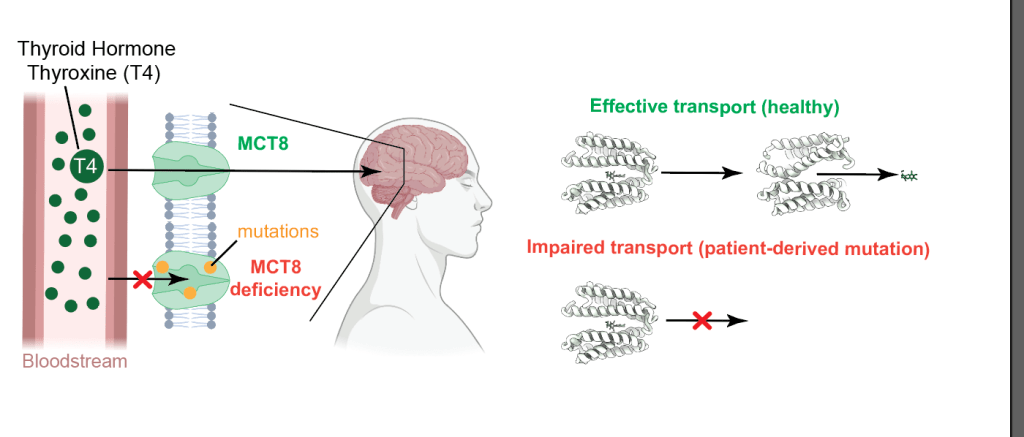
Infine, i dati strutturali forniscono le basi per comprendere come cambiamenti conformazionali sottili, indotti da mutazioni o inibitori, possano alterare drasticamente la funzione del trasportatore. Questa intuizione è particolarmente rilevante per lo sviluppo di strategie terapeutiche volte a ripristinare la funzione del trasportatore nei pazienti con deficit di MCT8. L’impiego della cryo-EM per determinare molteplici stati di MCT8 e MCT10 dimostra il valore della biologia strutturale nell’approfondire i meccanismi molecolari dei trasportatori di membrana, aprendo la strada a interventi terapeutici mirati per i disturbi metabolici e neuroevolutivi associati al trasporto degli ormoni tiroidei.
Tassinari et al. Molecular mechanism of thyroxine transport by monocarboxylate transporters. Nat Commun 16, 4493 (2025). https://doi.org/10.1038/s41467-025-59751-w
Questo lavoro è stato finanziato dal grant ERC THYROMOL #101041298 a Francesca Coscia.
Le immagini di questo articolo sono state create utilizzando BioRender.