Testa Group
Il Testa Group sfrutta il potenziale senza precedenti della riprogrammazione cellulare per studiare le basi molecolari delle malattie neuropsichiatriche e neurologiche umane (NPD), analizzando le dinamiche del loro svolgimento in modelli fisiopatologicamente rilevanti e a cavallo tra più scale di analisi: dalla risoluzione di singola cellula (single cell) alla funzione dell’organismo.
Uno dei risultati più tangibili della riprogrammazione delle cellule somatiche è stato un cambiamento di paradigma nella nostra capacità di modellare le malattie umane, che è finora stata caratterizzata da alcuni limiti fondamentali: i) la scarsa disponibilità di tessuti primari malati, particolarmente per i disturbi del sistema nervoso; e ii) la difficoltà di ricostruire le traiettorie di sviluppo e le traiettorie specifiche del paziente durante il dispiegarsi delle malattie.
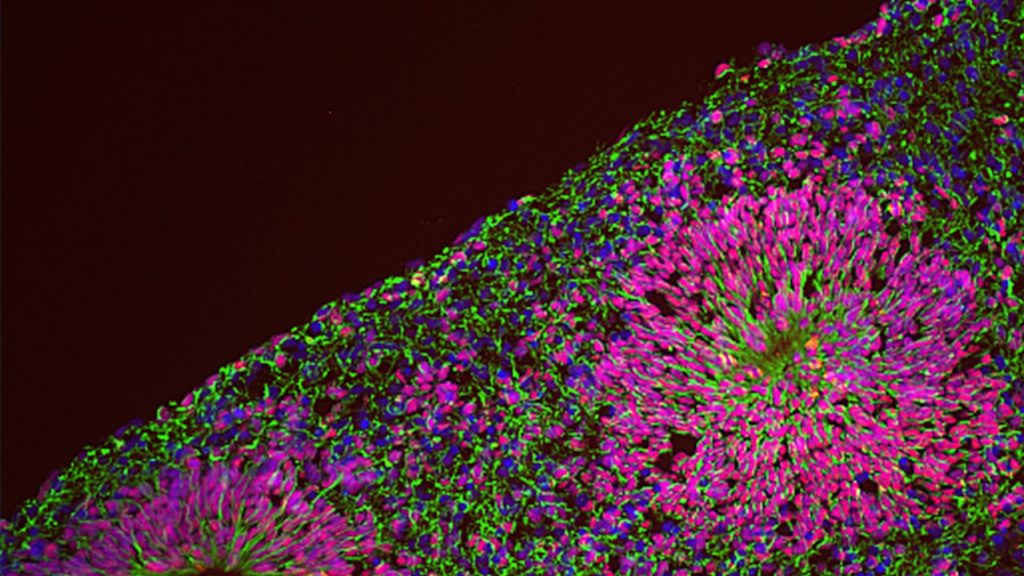
Stiamo quindi perseguendo la modellazione delle NPD con cellule staminali pluripotenti indotte umane (iPSC) accoppiate con la differenziazione in lignaggi rilevanti attraverso una serie di paradigmi sperimentali complementari, tra cui i neuroni glutammatergici inducendo l’espressione della neurogenin-2 (NGN2), le cellule staminali della cresta neurale e gli organoidi cerebrali tridimensionali che ricapitolano alcune fasi salienti dello sviluppo cerebrale precoce, compresa la diversità delle popolazioni di cellule che è unica al livello del cervello umano. Questo ci permette di distinguere le componenti genetiche e ambientali della patogenesi della NPD, per mezzo di diversi approcci “omici” su larga scala e ad una risoluzione di singola cellula integrata con l’imaging ad alta processività e saggi funzionali in vitro e in vivo.
Il Testa Group si concentra su una serie di sindromi altamente informative che si presentano con disabilità intellettuale e disturbi dello spettro autistico che sono causate da mutazioni o alterazioni del dosaggio dei regolatori epigenetici e fattori di trascrizione, tra cui la sindrome di Williams-Beuren e la sindrome da micro-duplicazione 7q11. 23, sindrome di Kabuki, disturbi dello spettro autistico legati all’ADNP, sindrome di Weaver, sindrome di Gabriele-Testa-DeVries, nonché su fattori ambientali paradigmatici che hanno un impatto negativo sullo sviluppo neurologico, vale a dire le sostanze chimiche che alterano il sistema endocrino.
Infine, lo spettro dei disturbi dello sviluppo neurologico umano ci permette anche di indagare la logica delle reti di regolazione genica alla base dell’evoluzione del volto e del cervello umano moderno, integrando l’analisi delle dismorfologie cranio-facciali e delle alterazioni cerebrali per fare luce sulle traiettorie evoluzionistiche e di sviluppo alla base della moderna condizione umana.
Testa Group 2023

Membri del gruppo
-
 Giuseppe Testa
Giuseppe Testa
Head of Neurogenomics -
 Davide Aprile
Davide Aprile
Postdoc -
 Lorenzo Basile
Lorenzo Basile
Undergraduate Intern -
 Nicolò Caporale
Nicolò Caporale
Postdoctoral Associate -
 Davide Castaldi
Davide Castaldi
Postdoc Fellow -
 Lorenza Culotta
Lorenza Culotta
Senior Technician -
 Francesco Elli
Francesco Elli
Affiliate Scientist -
 Marlene Cristina Faria Pereira
Marlene Cristina Faria Pereira
Affiliate Scientist -
 Samuele Galimi
Samuele Galimi
Postgraduate Fellow -
 Oliviero Leonardi
Oliviero Leonardi
PhD Student -
 Lisa Mainardi
Lisa Mainardi
Scientific Visitor -
 Alessandro Melon
Alessandro Melon
Undergraduate Intern -
 Riccardo Nagni
Riccardo Nagni
Undergraduate Intern -
 Marco Tullio Rigoli
Marco Tullio Rigoli
Affiliate Scientist -
 Ludovico Rizzuti
Ludovico Rizzuti
Affiliate Scientist -
 Adrianos Skaros
Adrianos Skaros
Affiliate Scientist -
 Sarah Stucchi
Sarah Stucchi
PhD Student -
 Alejandro Lopez Tobon
Alejandro Lopez Tobon
Scientific Advisor -
 Alessandro Valente
Alessandro Valente
Affiliate Scientist -
 Alessia Valenti
Alessia Valenti
PhD Student -
 Emanuele Villa
Emanuele Villa
Senior Staff Scientist -
 Alessandro Vitriolo
Alessandro Vitriolo
Affiliate Scientist -
 Narges Yahyazadeh
Narges Yahyazadeh
Scientific Visitor
Pubblicazioni
-
10/2022 - BioRxiv
7q11.23 CNV alters protein synthesis and REST-mediated neuronal intrinsic excitability
Copy number variations (CNVs) at 7q11.23 cause Williams-Beuren (WBS) and 7q microduplication syndromes (7Dup), two neurodevelopmental disorders with shared and opposite cognitive-behavioral phenotypes. Using patient-derived and isogenic neurons, we integrated transcriptomics, translatomics and proteomics to elucidate the molecular underpinnings of this dosage effect. We found that 7q11.23 CNVs cause opposite alterations in neuronal differentiation and […]
-
10/2022 - BioRxiv
GTF2I dosage regulates neuronal differentiation and social behavior in 7q11.23 neurodevelopmental disorders
Copy number variations at 7q11.23 cause neurodevelopmental disorders with shared and opposite manifestations. Deletion causes Williams-Beuren syndrome (WBS), while duplication causes 7q11.23 microduplication syndrome (7Dup). Converging evidence indicates GTF2I, from the 7q11.23 locus, is a key mediator of the cognitive-behavioral phenotypes associated with WBS and 7Dup. Here we integrate molecular profiling of patient-derived cortical organoids (COs) […]
-
09/2022 - Nature
A nomenclature consensus for nervous system organoids and assembloids
Self-organizing three-dimensional cellular models derived from human pluripotent stem cells or primary tissue have great potential to provide insights into how the human nervous system develops, what makes it unique and how disorders of the nervous system arise, progress and could be treated. Here, to facilitate progress and improve communication with the scientific community and […]
-
05/2022 - Frontiers in Neuroscience
EZH2-Mediated H3K27me3 Targets Transcriptional Circuits of Neuronal Differentiation
The Polycomb Repressive Complex 2 (PRC2) plays important roles in the epigenetic regulation of cellular development and differentiation through H3K27me3-dependent transcriptional repression. Aberrant PRC2 activity has been associated with cancer and neurodevelopmental disorders, particularly with respect to the malfunction of sits catalytic subunit EZH2. Here, we investigated the role of the EZH2-mediated H3K27me3 apposition in […]