Come il genoma umano si compatta durante la divisione cellulare
Attraverso una collaborazione internazionale, i ricercatori di Human Technopole hanno identificato M18BP1 come attivatore della condensina II, un complesso molecolare essenziale per la compattazione del DNA durante la divisione cellulare. M18BP1 svolge questo ruolo attraverso un meccanismo regolato dalla fosforilazione che lo mette in competizione con un’altra proteina, MCPH1. Questo meccanismo, finora sconosciuto, colma una lacuna importante nella nostra comprensione della mitosi e apre nuove prospettive per lo studio delle malattie legate a difetti della divisione cellulare. I risultati sono stati pubblicati sulla rivista Molecular Cell.
Durante la divisione cellulare, il DNA presente nel nucleo subisce un’importante trasformazione: viene compattato e organizzato in cromosomi, per poi essere distribuito in modo preciso tra le due cellule figlie. Questo processo, chiamato condensazione dei cromosomi, è reso possibile da complessi proteici noti come condensine. Nelle cellule umane esistono due tipi di condensine – condensina I e condensina II – che intervengono in momenti diversi del processo e con modalità differenti: la condensina II agisce nelle prime fasi della condensazione, mentre la condensina I entra in gioco più tardi.
Una delle domande da lungo tempo irrisolte nella biologia cellulare riguarda come la condensina II venga attivata all’inizio della divisione cellulare.
Per rispondere a questa domanda, il gruppo di Alessandro Vannini (Human Technopole, Milano), insieme a ricercatori del Max Planck Institute (Dortmund), del Netherlands Cancer Institute (Amsterdam) e dell’Università di Sheffield, ha individuato in M18BP1 l'”interruttore molecolare” che consente alla condensina II di entrare in azione nelle cellule animali in fase di divisione.
Attraverso analisi genomiche e proteomiche, il team ha scoperto che M18BP1 si lega direttamente alla condensina II grazie a un breve tratto della sua struttura. Questo legame permette al complesso molecolare della condensina di ancorarsi alla cromatina (la sostanza di cui sono fatti i cromosomi) e di avviare la compattazione del DNA.
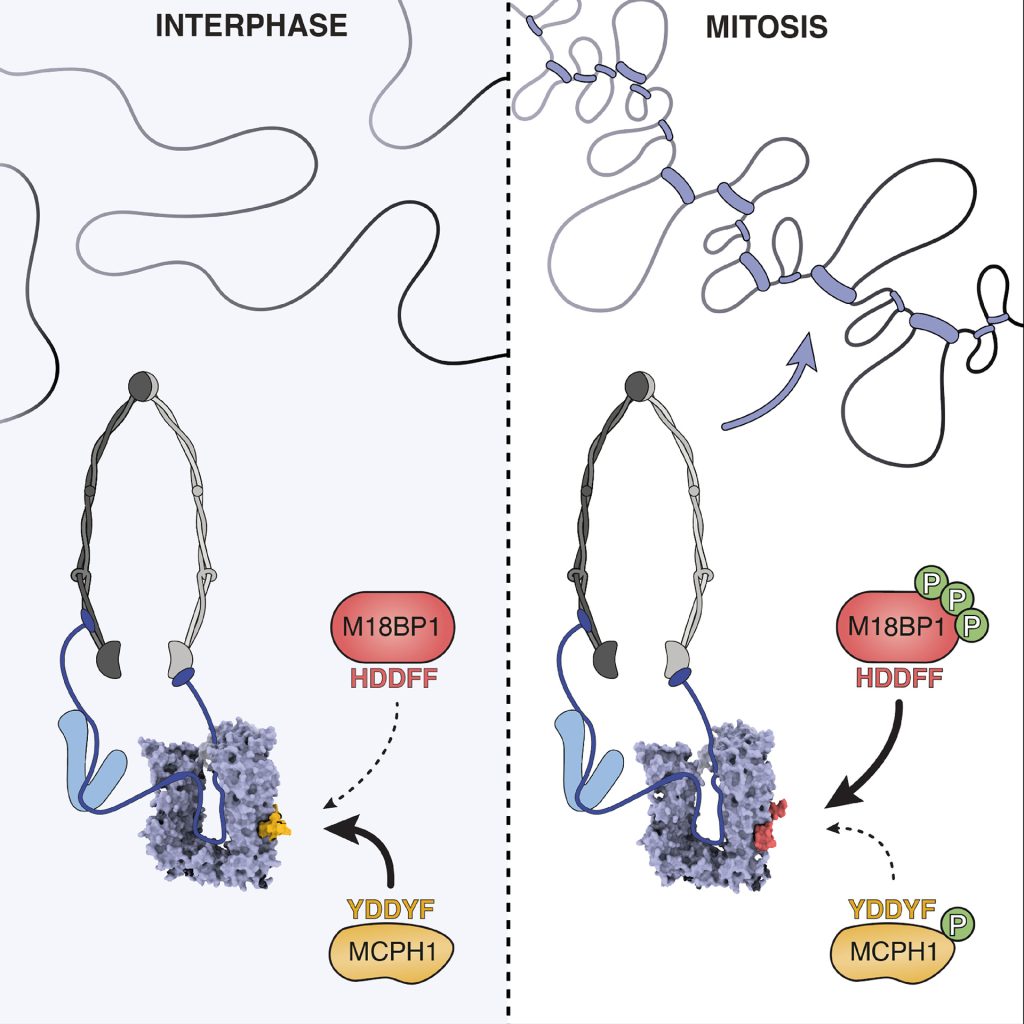
Inaspettatamente, gli scienziati hanno osservato che un’altra proteina, MCPH1, impedisce questo processo nella maggior parte del ciclo cellulare, legandosi alla condensina II in modo competitivo rispetto a M18BP1. In questo modo, mantiene il DNA in uno stato non condensato finché la cellula non è pronta a dividersi.
È proprio questa competizione a regolare l’inizio della condensazione. Quando la cellula entra in mitosi, l’enzima CDK1 fosforila entrambe le proteine: ciò riduce l’affinità di MCPH1 per la condensina II e rafforza quella di M18BP1, consentendo finalmente alla condensina II di raggiungere i cromosomi.
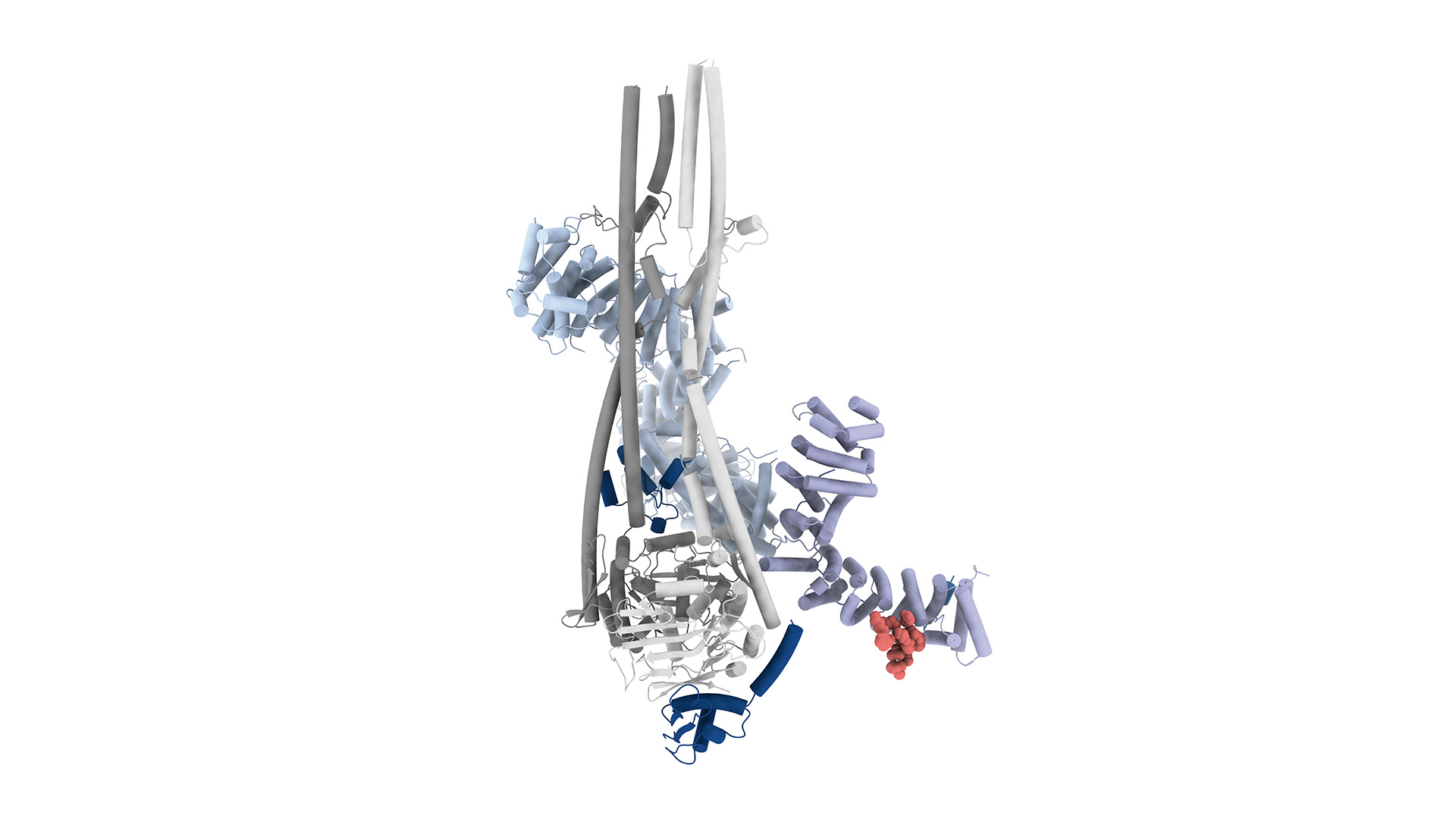
Grazie a tecniche avanzate di microscopia (cryo-EM), i ricercatori hanno potuto osservare nei dettagli l’interazione tra M18BP1 e la condensina II, ricostruendo una mappa strutturale del complesso. Hanno inoltre creato mutanti di M18BP1 incapaci di legarsi alla condensina II e dimostrato che, in assenza di questo legame, la condensazione dei cromosomi non avviene, pur restando intatte altre funzioni di M18BP1, come il ruolo nella formazione dei centromeri. Questo dimostra che M18BP1 svolge un doppio ruolo: contribuisce sia al mantenimento dei cromosomi che alla preparazione alla divisione.
Oltre a far luce su un aspetto fondamentale della mitosi, queste scoperte potrebbero avere risvolti clinici. Per esempio, alcune mutazioni nella proteina MCPH1 sono collegate alla microcefalia, una condizione caratterizzata da un ridotto sviluppo cerebrale. Lo studio suggerisce che un’alterazione nella regolazione della condensina II da parte di M18BP1 potrebbe contribuire a questi disturbi, provocando una condensazione dei cromosomi troppo precoce.