Testa Group
Il Testa Group sfrutta il potenziale senza precedenti della riprogrammazione cellulare per studiare le basi molecolari delle malattie neuropsichiatriche e neurologiche umane (NPD), analizzando le dinamiche del loro svolgimento in modelli fisiopatologicamente rilevanti e a cavallo tra più scale di analisi: dalla risoluzione di singola cellula (single cell) alla funzione dell’organismo.
Uno dei risultati più tangibili della riprogrammazione delle cellule somatiche è stato un cambiamento di paradigma nella nostra capacità di modellare le malattie umane, che è finora stata caratterizzata da alcuni limiti fondamentali: i) la scarsa disponibilità di tessuti primari malati, particolarmente per i disturbi del sistema nervoso; e ii) la difficoltà di ricostruire le traiettorie di sviluppo e le traiettorie specifiche del paziente durante il dispiegarsi delle malattie.
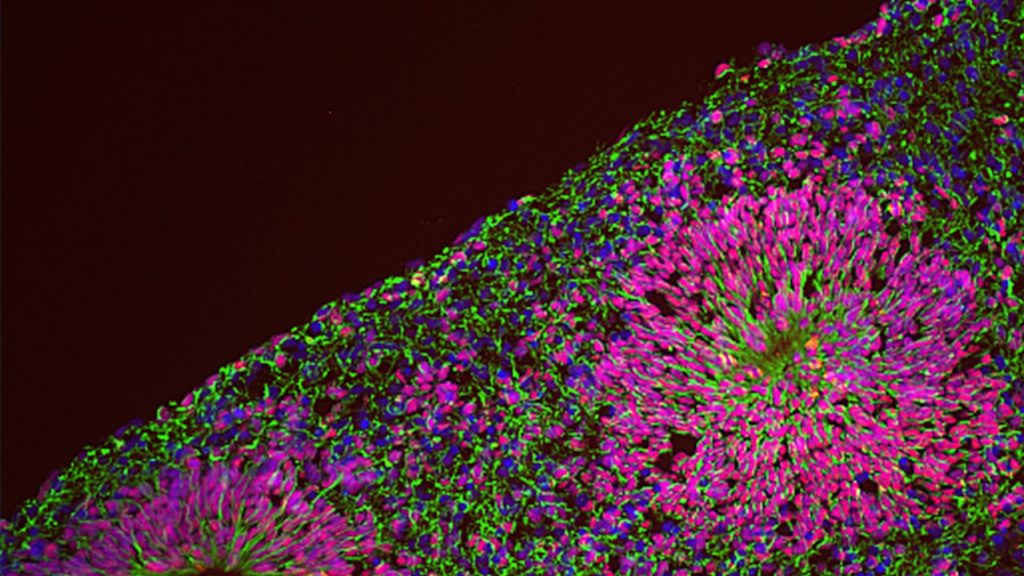
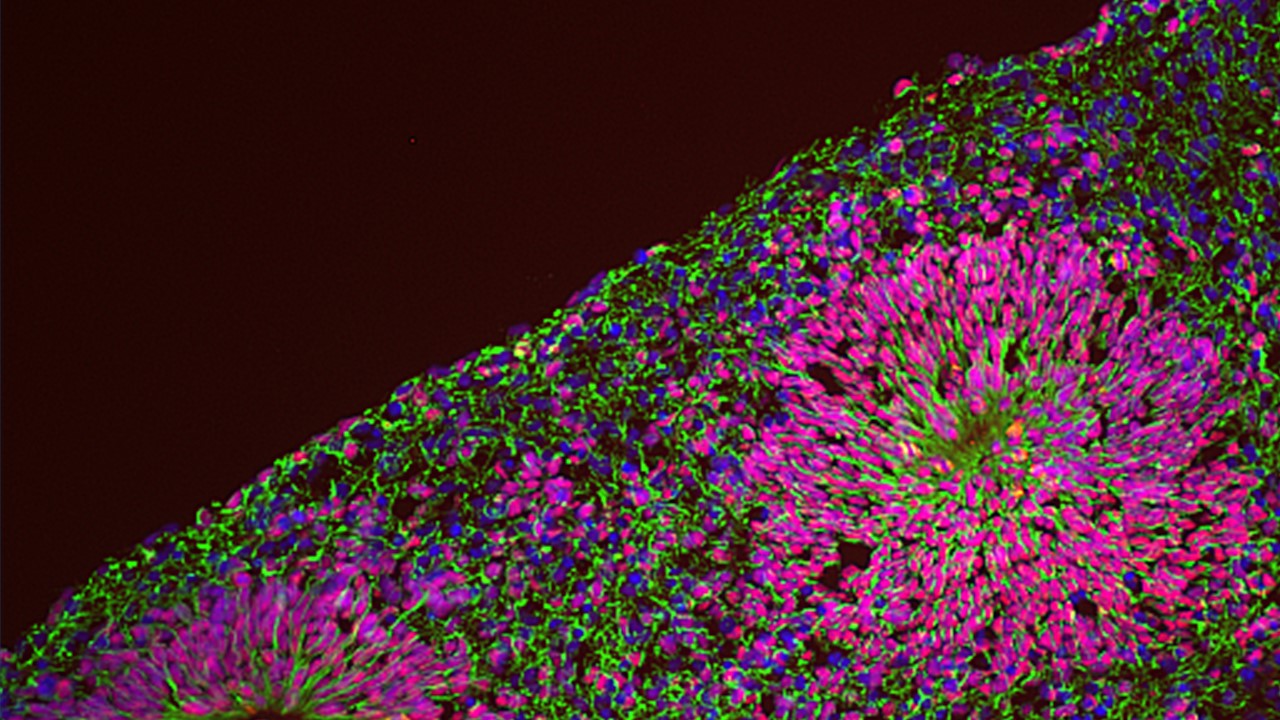
Stiamo quindi perseguendo la modellazione delle NPD con cellule staminali pluripotenti indotte umane (iPSC) accoppiate con la differenziazione in lignaggi rilevanti attraverso una serie di paradigmi sperimentali complementari, tra cui i neuroni glutammatergici inducendo l’espressione della neurogenin-2 (NGN2), le cellule staminali della cresta neurale e gli organoidi cerebrali tridimensionali che ricapitolano alcune fasi salienti dello sviluppo cerebrale precoce, compresa la diversità delle popolazioni di cellule che è unica al livello del cervello umano. Questo ci permette di distinguere le componenti genetiche e ambientali della patogenesi della NPD, per mezzo di diversi approcci “omici” su larga scala e ad una risoluzione di singola cellula integrata con l’imaging ad alta processività e saggi funzionali in vitro e in vivo.
Il Testa Group si concentra su una serie di sindromi altamente informative che si presentano con disabilità intellettuale e disturbi dello spettro autistico che sono causate da mutazioni o alterazioni del dosaggio dei regolatori epigenetici e fattori di trascrizione, tra cui la sindrome di Williams-Beuren e la sindrome da micro-duplicazione 7q11. 23, sindrome di Kabuki, disturbi dello spettro autistico legati all’ADNP, sindrome di Weaver, sindrome di Gabriele-Testa-DeVries, nonché su fattori ambientali paradigmatici che hanno un impatto negativo sullo sviluppo neurologico, vale a dire le sostanze chimiche che alterano il sistema endocrino.
Infine, lo spettro dei disturbi dello sviluppo neurologico umano ci permette anche di indagare la logica delle reti di regolazione genica alla base dell’evoluzione del volto e del cervello umano moderno, integrando l’analisi delle dismorfologie cranio-facciali e delle alterazioni cerebrali per fare luce sulle traiettorie evoluzionistiche e di sviluppo alla base della moderna condizione umana.
Testa Group 2023

Membri del gruppo
-
 Giuseppe Testa
Giuseppe Testa
Head of Neurogenomics -
 Davide Aprile
Davide Aprile
Postdoc -
 Lorenzo Basile
Lorenzo Basile
Undergraduate Intern -
 Nicolò Caporale
Nicolò Caporale
Postdoctoral Associate -
 Davide Castaldi
Davide Castaldi
Postdoc Fellow -
 Lorenza Culotta
Lorenza Culotta
Senior Technician -
 Francesco Elli
Francesco Elli
Affiliate Scientist -
 Marlene Cristina Faria Pereira
Marlene Cristina Faria Pereira
Affiliate Scientist -
 Samuele Galimi
Samuele Galimi
Postgraduate Fellow -
 Oliviero Leonardi
Oliviero Leonardi
PhD Student -
 Lisa Mainardi
Lisa Mainardi
Scientific Visitor -
 Alessandro Melon
Alessandro Melon
Undergraduate Intern -
 Riccardo Nagni
Riccardo Nagni
Undergraduate Intern -
 Marco Tullio Rigoli
Marco Tullio Rigoli
Affiliate Scientist -
 Ludovico Rizzuti
Ludovico Rizzuti
Affiliate Scientist -
 Adrianos Skaros
Adrianos Skaros
Affiliate Scientist -
 Sarah Stucchi
Sarah Stucchi
PhD Student -
 Alejandro Lopez Tobon
Alejandro Lopez Tobon
Scientific Advisor -
 Alessandro Valente
Alessandro Valente
Affiliate Scientist -
 Alessia Valenti
Alessia Valenti
PhD Student -
 Emanuele Villa
Emanuele Villa
Senior Staff Scientist -
 Alessandro Vitriolo
Alessandro Vitriolo
Affiliate Scientist -
 Narges Yahyazadeh
Narges Yahyazadeh
Scientific Visitor
Pubblicazioni
-
04/2022 - BioRxiv
Benchmarking brain organoid recapitulation of fetal corticogenesis
Brain organoids are becoming increasingly relevant to dissect the molecular mechanisms underlying psychiatric and neurological conditions. The in vitro recapitulation of key features of human brain development affords the unique opportunity of investigating the developmental antecedents of neuropsychiatric conditions in the context of the actual patients’ genetic backgrounds. Specifically, multiple strategies of brain organoid (BO) differentiation have […]
-
04/2022 - Cell Reports
CHD8 haploinsufficiency links autism to transient alterations in excitatory and inhibitory trajectories
Mutations in the chromodomain helicase DNA-binding 8 (CHD8) gene are a frequent cause of autism spectrum disorder (ASD). While its phenotypic spectrum often encompasses macrocephaly, implicating cortical abnormalities, how CHD8 haploinsufficiency affects neurodevelopmental is unclear. Here, employing human cerebral organoids, we find that CHD8 haploinsufficiency disrupted neurodevelopmental trajectories with an accelerated and delayed generation of, respectively, inhibitory and excitatory neurons that yields, at days 60 […]
-
03/2022 - International Journal of Molecular Sciences
The ENDpoiNTs Project: Novel Testing Strategies for Endocrine Disruptors Linked to Developmental Neurotoxicity
Ubiquitous exposure to endocrine-disrupting chemicals (EDCs) has caused serious concerns about the ability of these chemicals to affect neurodevelopment, among others. Since endocrine disruption (ED)-induced developmental neurotoxicity (DNT) is hardly covered by the chemical testing tools that are currently in regulatory use, the Horizon 2020 research and innovation action ENDpoiNTs has been launched to fill […]
-
10/2021 - Frontiers in Cellular Neuroscience
Novel in vitro Experimental Approaches to Study Myelination and Remyelination in the Central Nervous System
Myelin is the lipidic insulating structure enwrapping axons and allowing fast saltatory nerve conduction. In the central nervous system, myelin sheath is the result of the complex packaging of multilamellar extensions of oligodendrocyte (OL) membranes. Before reaching myelinating capabilities, OLs undergo a very precise program of differentiation and maturation that starts from OL precursor cells […]