Testa Group
Il Testa Group sfrutta il potenziale senza precedenti della riprogrammazione cellulare per studiare le basi molecolari delle malattie neuropsichiatriche e neurologiche umane (NPD), analizzando le dinamiche del loro svolgimento in modelli fisiopatologicamente rilevanti e a cavallo tra più scale di analisi: dalla risoluzione di singola cellula (single cell) alla funzione dell’organismo.
Uno dei risultati più tangibili della riprogrammazione delle cellule somatiche è stato un cambiamento di paradigma nella nostra capacità di modellare le malattie umane, che è finora stata caratterizzata da alcuni limiti fondamentali: i) la scarsa disponibilità di tessuti primari malati, particolarmente per i disturbi del sistema nervoso; e ii) la difficoltà di ricostruire le traiettorie di sviluppo e le traiettorie specifiche del paziente durante il dispiegarsi delle malattie.
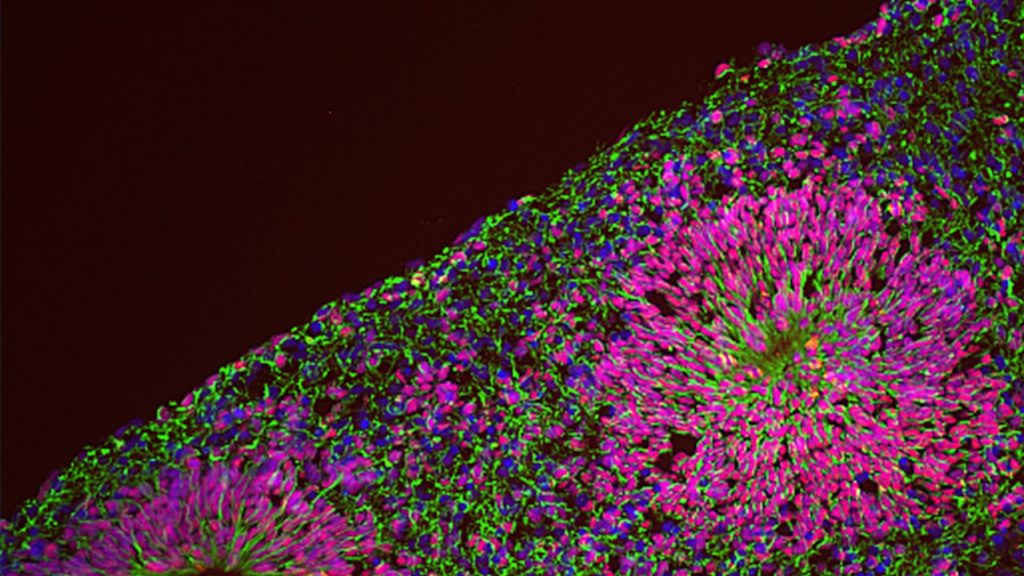
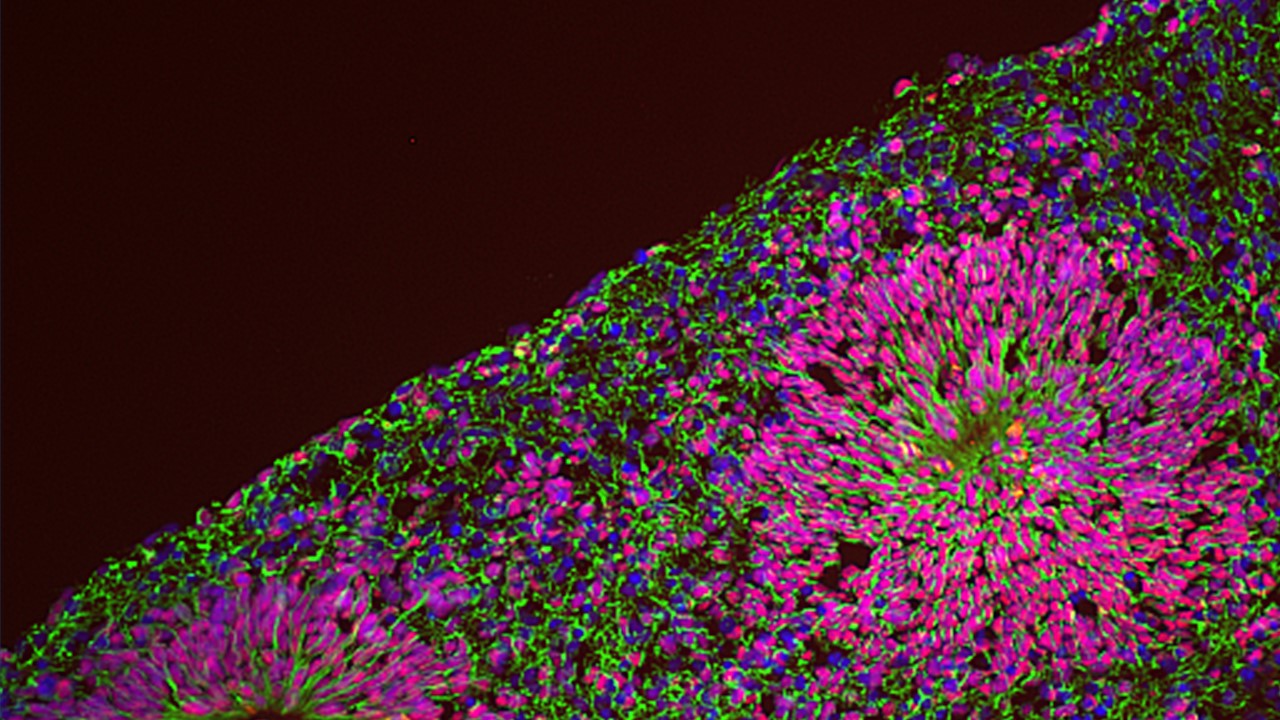
Stiamo quindi perseguendo la modellazione delle NPD con cellule staminali pluripotenti indotte umane (iPSC) accoppiate con la differenziazione in lignaggi rilevanti attraverso una serie di paradigmi sperimentali complementari, tra cui i neuroni glutammatergici inducendo l’espressione della neurogenin-2 (NGN2), le cellule staminali della cresta neurale e gli organoidi cerebrali tridimensionali che ricapitolano alcune fasi salienti dello sviluppo cerebrale precoce, compresa la diversità delle popolazioni di cellule che è unica al livello del cervello umano. Questo ci permette di distinguere le componenti genetiche e ambientali della patogenesi della NPD, per mezzo di diversi approcci “omici” su larga scala e ad una risoluzione di singola cellula integrata con l’imaging ad alta processività e saggi funzionali in vitro e in vivo.
Il Testa Group si concentra su una serie di sindromi altamente informative che si presentano con disabilità intellettuale e disturbi dello spettro autistico che sono causate da mutazioni o alterazioni del dosaggio dei regolatori epigenetici e fattori di trascrizione, tra cui la sindrome di Williams-Beuren e la sindrome da micro-duplicazione 7q11. 23, sindrome di Kabuki, disturbi dello spettro autistico legati all’ADNP, sindrome di Weaver, sindrome di Gabriele-Testa-DeVries, nonché su fattori ambientali paradigmatici che hanno un impatto negativo sullo sviluppo neurologico, vale a dire le sostanze chimiche che alterano il sistema endocrino.
Infine, lo spettro dei disturbi dello sviluppo neurologico umano ci permette anche di indagare la logica delle reti di regolazione genica alla base dell’evoluzione del volto e del cervello umano moderno, integrando l’analisi delle dismorfologie cranio-facciali e delle alterazioni cerebrali per fare luce sulle traiettorie evoluzionistiche e di sviluppo alla base della moderna condizione umana.
Testa Group 2023

Membri del gruppo
-
 Giuseppe Testa
Giuseppe Testa
Head of Neurogenomics -
 Davide Aprile
Davide Aprile
Postdoc -
 Lorenzo Basile
Lorenzo Basile
Undergraduate Intern -
 Nicolò Caporale
Nicolò Caporale
Postdoctoral Associate -
 Davide Castaldi
Davide Castaldi
Postdoc Fellow -
 Lorenza Culotta
Lorenza Culotta
Senior Technician -
 Francesco Elli
Francesco Elli
Affiliate Scientist -
 Marlene Cristina Faria Pereira
Marlene Cristina Faria Pereira
Affiliate Scientist -
 Samuele Galimi
Samuele Galimi
Postgraduate Fellow -
 Oliviero Leonardi
Oliviero Leonardi
PhD Student -
 Lisa Mainardi
Lisa Mainardi
Scientific Visitor -
 Alessandro Melon
Alessandro Melon
Undergraduate Intern -
 Riccardo Nagni
Riccardo Nagni
Undergraduate Intern -
 Marco Tullio Rigoli
Marco Tullio Rigoli
Affiliate Scientist -
 Ludovico Rizzuti
Ludovico Rizzuti
Affiliate Scientist -
 Adrianos Skaros
Adrianos Skaros
Affiliate Scientist -
 Sarah Stucchi
Sarah Stucchi
PhD Student -
 Alejandro Lopez Tobon
Alejandro Lopez Tobon
Scientific Advisor -
 Alessandro Valente
Alessandro Valente
Affiliate Scientist -
 Alessia Valenti
Alessia Valenti
PhD Student -
 Emanuele Villa
Emanuele Villa
Senior Staff Scientist -
 Alessandro Vitriolo
Alessandro Vitriolo
Affiliate Scientist -
 Narges Yahyazadeh
Narges Yahyazadeh
Scientific Visitor
Pubblicazioni
-
07/2021 - Autophagy
Imbalanced autophagy causes synaptic deficits in a human model for neurodevelopmental disorders
Macroautophagy (hereafter referred to as autophagy) is a finely tuned process of programmed degradation and recycling of proteins and cellular components, which is crucial in neuronal function and synaptic integrity. Mounting evidence implicates chromatin remodeling in fine-tuning autophagy pathways. However, this epigenetic regulation is poorly understood in neurons. Here, we investigate the role in autophagy […]
-
12/2020 - The EMBO Journal
COVID-19 lessons from the dish: Dissecting CNS manifestations through brain organoids
COVID-19 is increasingly understood as a systemic disease with pathogenic manifestations beyond the respiratory tract. Recent work by Ramani et al (2020) dissects the cellular and molecular mechanisms of SARS-CoV-2’s neurotrophic properties, using viral exposure of human brain organoids. Their findings highlight neurons as primary target of cerebral SARS-CoV-2 infection and uncover its Tau-related neurotoxicity.
-
11/2020 - Molecular Autism
High-throughput screening identifies histone deacetylase inhibitors that modulate GTF2I expression in 7q11.23 microduplication autism spectrum disorder patient-derived cortical neurons
Background Autism spectrum disorder (ASD) is a highly prevalent neurodevelopmental condition affecting almost 1% of children, and represents a major unmet medical need with no effective drug treatment available. Duplication at 7q11.23 (7Dup), encompassing 26–28 genes, is one of the best characterized ASD-causing copy number variations and offers unique translational opportunities, because the hemideletion of […]
-
09/2020 - Molecular Autism
Autism spectrum disorder at the crossroad between genes and environment: contributions, convergences, and interactions in ASD developmental pathophysiology
The complex pathophysiology of autism spectrum disorder encompasses interactions between genetic and environmental factors. On the one hand, hundreds of genes, converging at the functional level on selective biological domains such as epigenetic regulation and synaptic function, have been identified to be either causative or risk factors of autism. On the other hand, exposure to […]
-
09/2020 - Nature
LifeTime and improving European healthcare through cell-based interceptive medicine
LifeTime aims to track, understand and target human cells during the onset and progression of complex diseases and their response to therapy at single-cell resolution. This mission will be implemented through the development and integration of single-cell multi-omics and imaging, artificial intelligence and patient-derived experimental disease models during progression from health to disease. Analysis of […]