Vannini Group
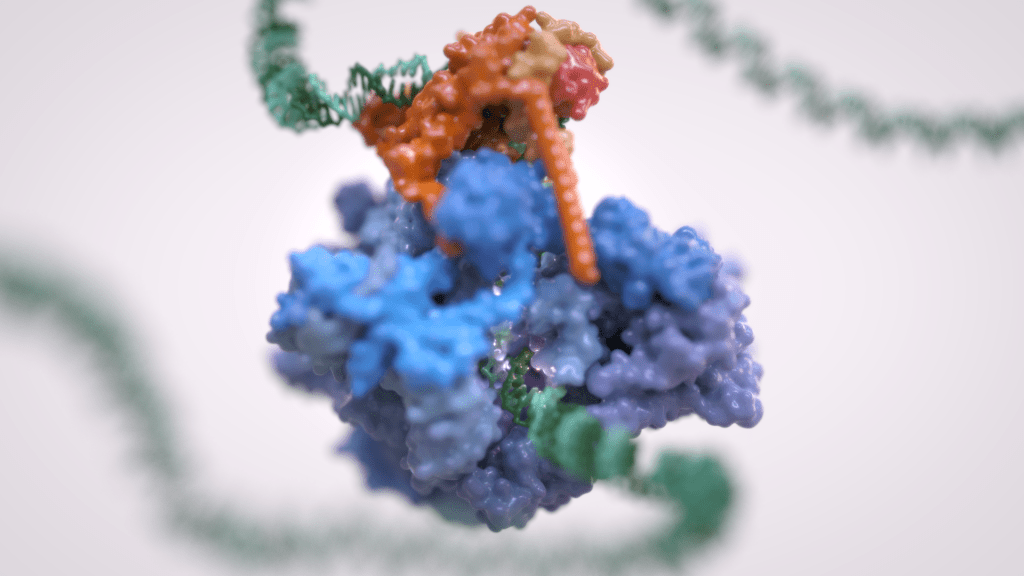
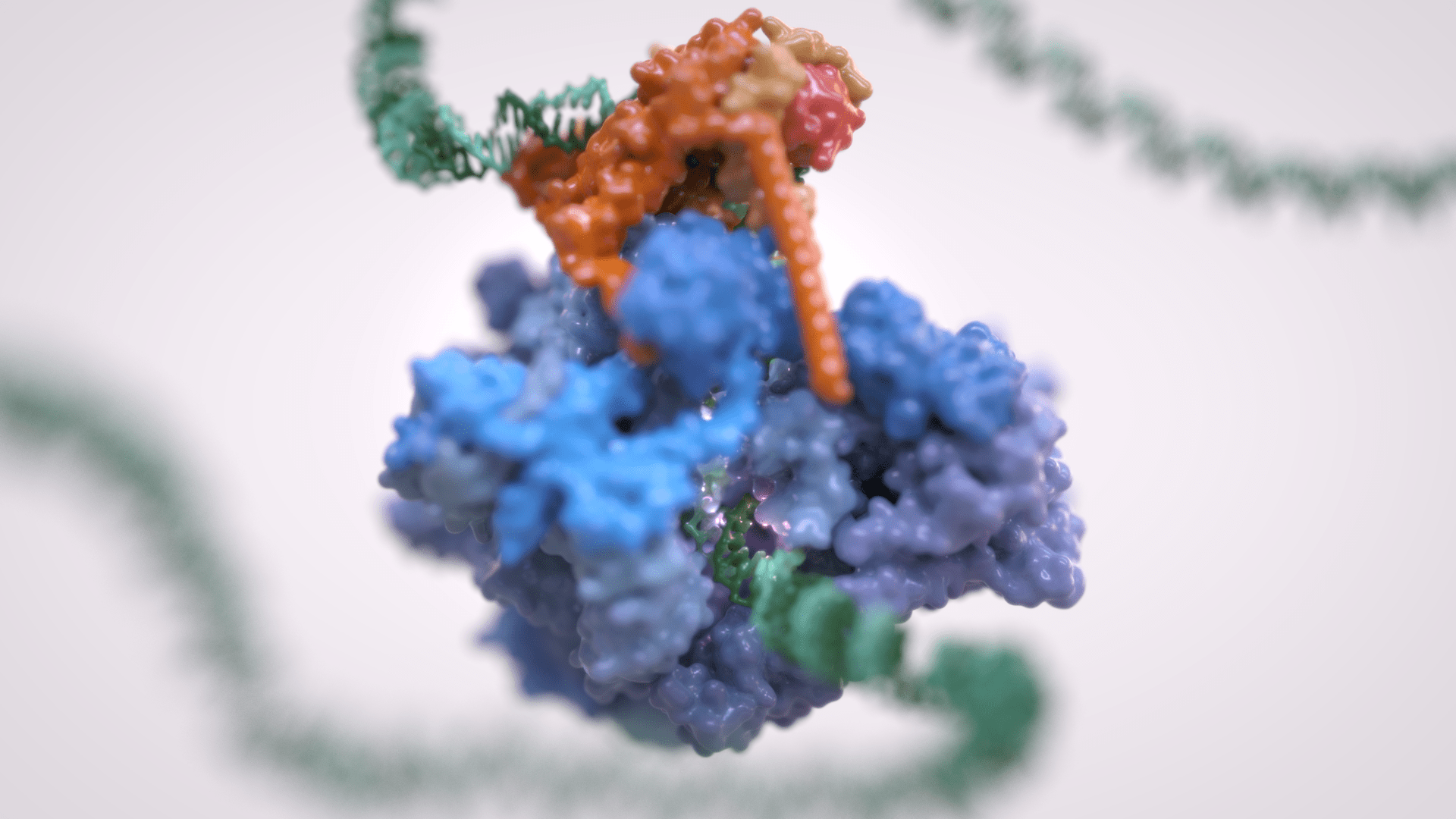
La trascrizione genica è il primo passaggio che regola l’espressione dell’informazione genetica codificata in un genoma, ed è alla base della differenziazione cellulare e dello sviluppo dell’organismo. La trascrizione genica eucariotica avviene nel contesto di genomi altamente strutturati e organizzati e coordina numerosi eventi che si verificano nel nucleo. La trascrizione eucariotica si basa su tre diverse RNA polimerasi: L’RNA polimerasi I (Pol I) trascrive l’RNA ribosomiale, l’RNA polimerasi II (Pol II) sintetizza gli RNA messaggeri e l’RNA polimerasi III (Pol III) produce RNA brevi e non tradotti, compreso l’intero pool di tRNA, che sono essenziali per la crescita cellulare.
Per molto tempo si è ritenuto che solo Pol II fosse regolata e che Pol I e Pol III non richiedessero tale controllo, essendo dedicati a geni housekeeping. Tuttavia, è ora chiaro come la trascrizione dell’RNA polimerasi III sia strettamente regolata e sia un fattore determinante per la crescita di un organismo. La deregolazione di Pol III è stata osservata in varie forme di cancro e mutazioni genetiche a carico di Pol III causano gravi malattie neurodegenerative.
Inoltre, Pol III e i suoi fattori associati svolgono un ruolo fondamentale nella struttura e nell’organizzazione del genoma. Questi “ruoli extra-trascrizionali” sono svolti attraverso interazioni con altri componenti cellulari quali i transposoni, i complessi SMC (dall’inglese Structural Maintenance of Chromosomes) e i rimodellatori specifici della cromatina.
Il Vannini Group utilizza un approccio di Biologia Strutturale Integrativa, che combina analisi di crio-microscopia elettronica all’avanguardia, dati di diffrazione dei raggi X, cross-linking e spettrometria di massa nativa. Integriamo i dati strutturali con le tecniche di biologia molecolare e cellulare per ottenere una visione globale di questi processi fondamentali e di come la loro errata regolazione possa condurre a malattie oncologiche e neurodegenerative.
Membri del gruppo
-
 Alessandro Vannini
Alessandro Vannini
Head of Structural Biology Research Centre -
 Alessandro Borsellini
Alessandro Borsellini
Postdoc -
 Giacomo Ettore Casale
Giacomo Ettore Casale
Postdoc -
 Valentina Cecatiello
Valentina Cecatiello
Senior Technician -
 Sebastian Chamera
Sebastian Chamera
Postdoc -
 Fabiola Iommazzo
Fabiola Iommazzo
PhD Student -
 Thomas Noé Perry
Thomas Noé Perry
Postdoc -
 Fabio Pessina
Fabio Pessina
Senior Technician -
 Mariavittoria Pizzinga
Mariavittoria Pizzinga
Postdoc -
 Ewan Ramsay
Ewan Ramsay
Senior Staff Scientist -
 Ankit Roy
Ankit Roy
PhD Student -
 Syed Zawar Shah
Syed Zawar Shah
PhD Student
Pubblicazioni
-
08/2002 - Acta Crystallogr D Biol Crystallogr
Crystallization and preliminary X-ray diffraction studies of the transcriptional regulator TraR bound to its cofactor and to a specific DNA sequence
TraR is an Agrobacterium tumefaciens transcriptional regulator which binds the pheromone N-3-oxooctanoyl-L-homoserine lactone (AAI) in response to the bacterial population density. The TraR-AAI complex dimerizes and interacts with a specific 18-base-pair DNA sequence (TraBox), activating promoters containing this site. TraR was overexpressed and purified from Escherichia coli. Crystals of the ternary complex, in which dimeric […]
-
12/2001 - Eur J Biochem
Effect of ibuprofen and warfarin on the allosteric properties of haem-human serum albumin. A spectroscopic study
Haem binding to human serum albumin (HSA) endows the protein with peculiar spectroscopic properties. Here, the effect of ibuprofen and warfarin on the spectroscopic properties of ferric haem-human serum albumin (ferric HSA-haem) and of ferrous nitrosylated haem-human serum albumin (ferrous HSA-haem-NO) is reported. Ferric HSA-haem is hexa-coordinated, the haem-iron atom being bonded to His105 and […]
-
06/2001 - J Biol Inorg Chem
Relaxometric characterization of human hemalbumin
Hemalbumin [i.e., Fe(III)-protoporphyrin IX-human serum albumin; Fe(III)heme-HSA] is an important intermediate in the recovery of heme iron following hemolysis. Relaxometric data are consistent with the occurrence of a hexacoordinated high-spin Fe(III) center with no water in the inner coordination sphere. The relatively high relaxation enhancement observed for an aqueous solution of Fe(III)heme-HSA (r1p=4.8 mM(-1)s(-1) at […]
-
04/2001 - J Inorg Biochem
Effect of bezafibrate and clofibrate on the heme-iron geometry of ferrous nitrosylated heme-human serum albumin: an EPR study
The effect of bezafibrate (BZF) and clofibrate (CF), two therapeutic drugs displaying anticoagulant and antihyperlipoproteinemic activities, on the EPR-spectroscopic properties of ferrous nitrosylated heme-human serum albumin (HSA-heme-NO) has been investigated. In the absence of BZF and CF, HSA-heme-NO is a five-coordinate heme-iron system, characterised by an X-band EPR spectrum with a three-line splitting in the […]