Comprendere lo sviluppo dell’autismo grazie agli organoidi cerebrali
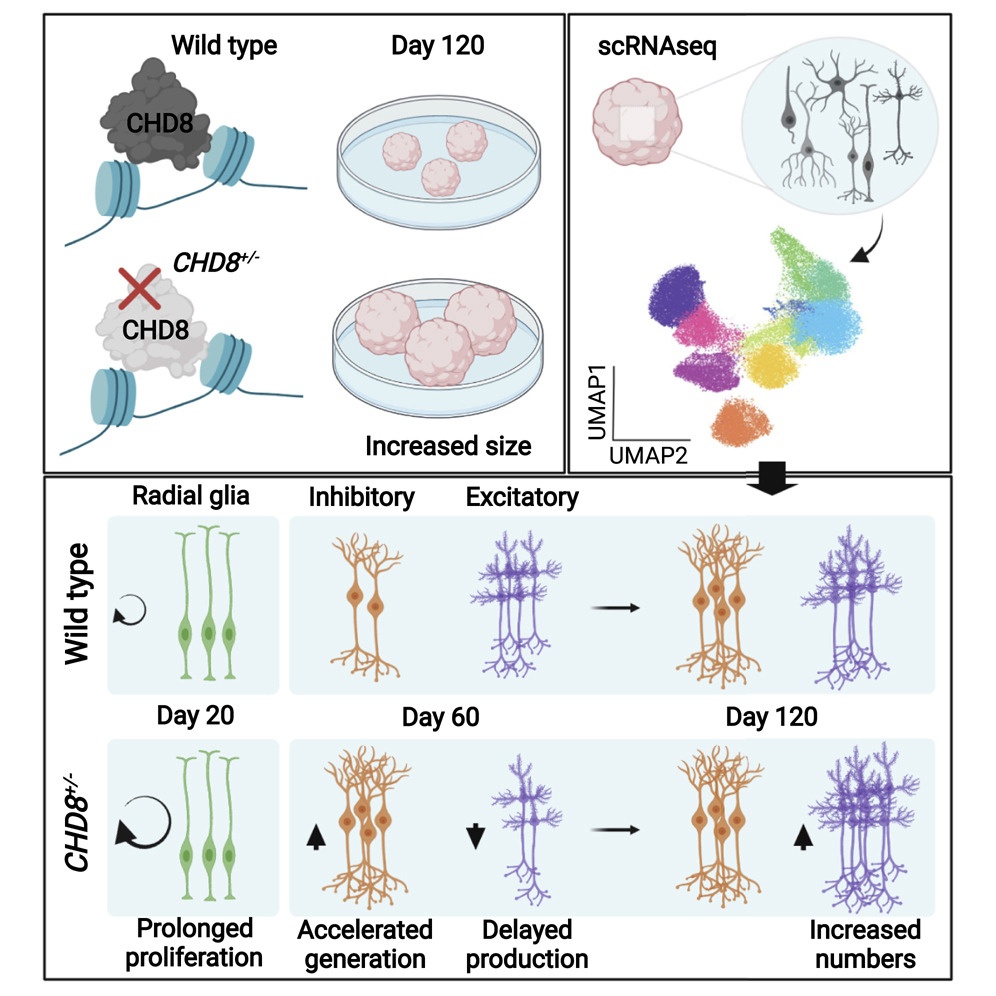
Nel disturbo dello spettro autistico, il fattore di rimodellamento della cromatina CHD8 è frequentemente mutato. Tuttavia, sappiamo ancora poco di come e quando CHD8 influenzi lo sviluppo del cervello. Un nuovo studio di Giuseppe Testa et al. descrive per la prima volta gli effetti dell’aploinsufficienza di CHD8 sul neurosviluppo umano nelle singole cellule.
Il disturbo dello spettro autistico (ASD) è una condizione neurologica che induce ansia, comportamenti ripetitivi e difficoltà di comunicazione e interazione con le altre persone.I geni che codificano per i fattori di rimodellamento della cromatina, come le DNA elicasi, sono spesso mutati nei pazienti ASD, e la chromodomain helicase DNA binding protein 8 (CHD8) è il più frequentemente mutato e penetrante tra loro. Nei mammiferi, le mutazioni eterozigoti loss-of-function (LoF) di CHD8 inducono ad un aumento della circonferenza della testa (o macrocefalia) e fenotipi simili all’ASD. Mentre i modelli animali hanno permesso di collegare CHD8 allo sviluppo del cervello, non sono riusciti a rivelare come e in quale fase CHD8 regoli il neurosviluppo. Infatti, nei topi, le mutazioni LoF di CHD8 sono solitamente associate a lievi problemi neurologici o a risultati contrastanti. Abbiamo quindi bisogno di modelli sperimentali alternativi per capire l’origine dello sviluppo dell’ASD nell’uomo.
Il team di Giuseppe Testa (Responsabile del Centro di Ricerca Neurogenomica di Human Technopole, Professore di Biologia Molecolare presso l’Università di Milano e Group Leader presso l’Istituto Europeo di Oncologia) e Gaia Novarino (Principal Investigator presso l’Istituto di Scienza e Tecnologia Austria – ISTA), ha utilizzato organoidi cerebrali – organi in miniatura che riproducono da vicino gli aspetti chiave del cervello umano in via di sviluppo in provetta – per studiare l’impatto dell’aploinsufficienza di CHD8 sullo sviluppo corticale umano nelle singole cellule. I risultati di questo studio sono ora pubblicati su Cell Reports.
In primo luogo, i ricercatori hanno impostato una procedura per permettere agli organoidi cerebrali di riprodurre in modo realistico le caratteristiche dello sviluppo corticale. Successivamente, hanno scoperto che l’espressione di CHD8 raggiungeva un picco negli organoidi di 36 giorni, suggerendo così che CHD8 potesse regolare specificamente quella fase di sviluppo dell’organoide. Per testare questa ipotesi, i ricercatori hanno ingegnerizzato cellule staminali embrionali umane (hESC), che proliferano illimitatamente e possono originare mini organi in vitro, per ottenere organoidi con una copia di CHD8 recante una mutazione inattivante o due mutazioni specifiche del paziente ASD, una sola delle quali è associata anche a macrocefalia e disabilità intellettuale.
“Trovare negli organoidi cerebrali letture specifiche che distinguono le mutazioni specifiche osservate nei pazienti, per esempio un aumento delle dimensioni dell’organoide che si verifica solo per le mutazioni dei pazienti con macrocefalia, dimostra il potere di questa tecnologia nel risolvere la complessità delle malattie umane attraverso proxy intermedi che possono essere studiati in vitro” dice Giuseppe Testa.
Ma in che modo avere solo la metà del dosaggio normale del gene CHD8 (cioè avere una sola copia funzionale delle due che normalmente erediteremmo dai nostri genitori) induce tale alterazione? “Per sviscerare questo aspetto, abbiamo profilato più di 75.000 cellule da organoidi cerebrali di controllo e mutanti, rivelando che l’aploinsufficienza di CHD8 ha alterato l’equilibrio tra le popolazioni cellulari specifiche dell’organoide” dice Emanuele Villa, primo autore dello studio. “Più in dettaglio, ha aumentato transitoriamente il numero di interneuroni mentre diminuiva quello dei neuroni eccitatori in specifiche finestre di sviluppo. Queste mutazioni CHD8 hanno anche indotto una proliferazione cellulare sostenuta e una crescita eccessiva dell’organoide”.
Infine, i team di ricerca hanno dimostrato che l’aploinsufficienza di CHD8 ha influenzato l’elaborazione dell’mRNA nei neuroni post-mitotici alterando lo splicing alternativo in un modo specifico della popolazione cellulare.
In sintesi, Villa et al. (10.1016/j.celrep.2022.110615) hanno ricavato da organoidi cerebrali e dalla trascrittomica di singole cellule informazioni sul ruolo temporale e specifico per ogni cellula di CHD8 durante lo sviluppo corticale. Mentre sono necessari ulteriori studi per capire come l’aploinsufficienza CHD8 regola meccanisticamente la proliferazione cellulare e le dinamiche di differenziazione nel cervello in via di sviluppo, questi risultati aprono la strada a nuovi approcci nella generazione di modelli delle malattie del neurosviluppo.



